Мутации гена EGFR
- Роль рецептора EGFR и мутаций гена EGFR в патогенезе НМРЛ
- Что такое EGFR?
- Зачем определять статус мутации гена EGFR?
- Какие биоматериалы могут быть отправлены на EGFR-тестирование
- О Программе тестирования мутаций гена EGFR у пациентов с НМРЛ
- Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
Многочисленные биологические исследования выявили повышенную активность рецептора EGFR и каскада, запускающегося при активации этого рецептора, у больных немелкоклеточным раком легкого.
Что такое EGFR?
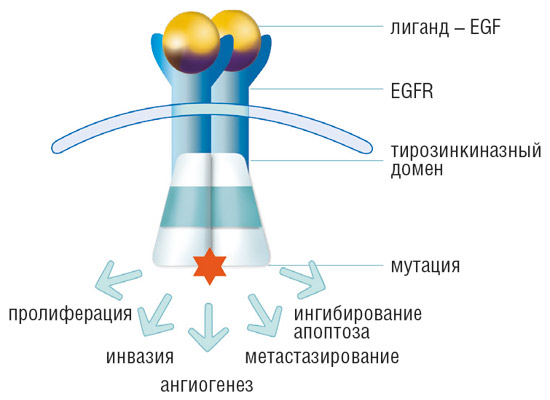
- EGFR – трансмембранный рецептор, активирующийся при связывании с эпидермальным фактором роста, трансформирующим фактором роста-α, амфирегулином.
- При активации EGFR внутри клетки запускается каскад биохимических реакций, приводящих к повышению пролиферации малигнизированных (опухолевых) клеток, росту опухоли, стимуляции процессов инвазии, патологического ангиогенеза и метастазирования.
- Рецептор EGFR кодируется геном EGFR.
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора роста, что обусловлено наличием мутации в соответствующем гене. В клетках с мутацией происходит активация сигнального пути EGFR, что, в свою очередь, инициирует процессы злокачественной трансформации в большинстве опухолей. Сигнальные пути контролируют процессы пролиферации, апоптоза – одного из механизмов клеточной гибели, утраты способности клеток к дифференцировке, процессы ангиогенеза и метастазирования.
Зачем определять статус мутации гена EGFR?
Тест на мутацию гена EGFR предназначен для отбора больных местно-распространенным или метастатическим немелкоклеточным раком легкого на терапию низкомолекулярными ингибиторами EGFR (ингибиторами тирозинкиназы).
Наличие мутаций гена EGFR позволяет выделить группу пациентов с наибольшей вероятностью выраженного ответа на терапию ингибиторами тирозинкиназы (гефитиниб).
Известны активирующие мутации гена EGFR, связанные с чувствительностью либо устойчивостью к ингибиторам тирозинкиназы. Подавляющее большинство мутаций, связанных с чувствительностью (~90%), – это делеции в 19 экзоне (Del19) или замена L858R в 21 экзоне. Опухоли с мутациями Del19 или L858R наиболее чувствительны к терапии ингибиторами тирозинкиназы EGFR. Прочие мутации, связанные с чувствительностью (G719X, L861Q, S768I и некоторые другие), составляют в сумме ~5% мутантных случаев.
Инсерции 20 экзона связаны с устойчивостью к ингибиторам тирозинкиназы и составляют ~3% опухолей с мутациями. Еще одна мутация, связанная с устойчивостью, – T790M. Частота выявления этой мутации после проведения химиотерапии ингибиторами тирозинкиназы составляет примерно 50%, однако в 1-3% случаев мутация может возникать de novo. Мутация T790M в гене EGFR является наиболее частой причиной возникновения резистентности к проводимой таргетной терапии. Своевременное выявление этой мутации позволяет выяснить причину резистентности и принять решение о смене терапии у пациента. Поэтому для назначения эффективной таргетной терапии всем больным немелкоклеточным раком легкого необходим анализ как на наличие мутаций чувствительности, так и на наличие/отсутствие мутаций устойчивости к ингибиторам тирозинкиназы.
Определение статуса мутации гена EGFR и персонализированный подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволят сделать лечение немелкоклеточного рака легкого более эффективным и приблизиться к международным тенденциям клинической практики.
Какие биоматериалы могут быть отправлены на EGFR-тестирование?
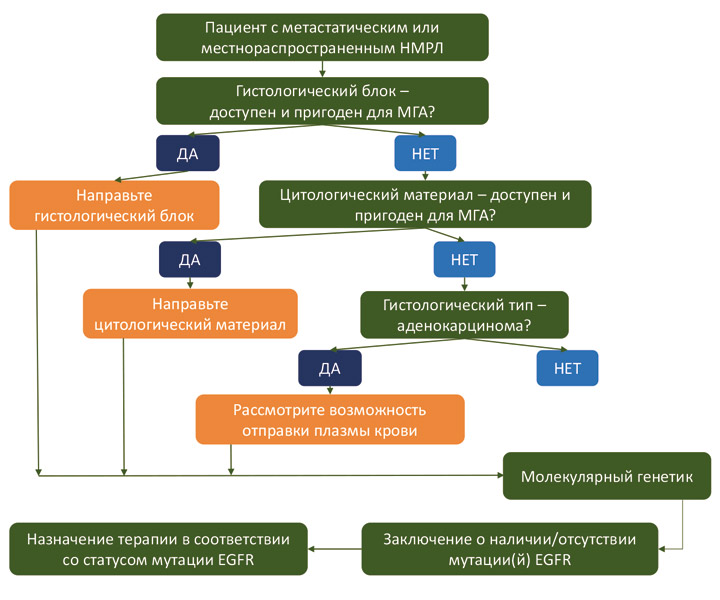
Анализ можно выполнить с использованием гистологического материала, цитологического материала или образца плазмы крови. Предпочтительна отправка гистологического материала, так как именно в этом случае достигается максимальная чувствительность анализа. Результативность тестирования по цитологическому материалу сопоставима с результатами, полученными для гистологических блоков. Если у пациента есть цитологический материал, то (в отсутствие гистологического) он представляет собой приемлемую альтернативу для EGFR-тестирования. В случаях, когда у пациента с аденокарциномой легкого отсутствует материал опухоли, следует рассмотреть возможность отправки плазмы крови на EGFR-тест. Несмотря на относительно низкую чувствительность и высокую трудоемкость анализа по плазме крови, он может быть единственной опцией для пациентов, чей опухолевый материал (гистологический или цитологический) утрачен или полностью израсходован на другие исследования.
Алгоритм выбора биоматериала для выполнения EGFR-тестирования приведен на схеме ниже:
Видеоинструкция по получению плазмы крови для EGFR-тестирования:
О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
- Тестирование в рамках Программы проводится на всей территории страны.
- Отправка материала и тестирование проводится бесплатно для врачей и пациентов.
Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
Пациентам с распространенным (местно-распространенным или метастатическим) немелкоклеточным раком лёгкого (в частности: аденокарцинома легкого, крупноклеточный рак, плоскоклеточный и аденоплоскоклеточный рак и др.).
![]() Благодарим ООО «АстраЗенека Фармасьютикалз» за спонсорскую поддержку тестирования.
Благодарим ООО «АстраЗенека Фармасьютикалз» за спонсорскую поддержку тестирования.
Список литературы:
- Reck M, Clint L. Lung Cancer. 2009 Jan; 63(1): 1-9.
- Lynch T, Bell DW. Sordella Retal. N Engl J Med. 2004 May 20; 350(21): 2129-3.
- Herbst RS, Hyemach JV, Lippman SM. N Engl J Med. 2008 Sep 25; 359(13): 1367-80.
- Gazdar AF, Shigematsu H, Herz J, Minna JD. Trends Mol Med. 2004 Oct; 10(10): 481-6.
- Mok T, et al. N Engl J Med 2009; 361: 947-957.
- Han J, et al. J Clin Oncol 2012; 30: 1122-1228.
- Maemondo M, et al. N Engl J Med 2010; 362: 2380-2388.
- Mitsudomi T, et al. Lancet Oncol 2010; 11: 121-128.
- Zhou C et al. Lancet Oncol 2011; 12: 735-742.
- Rosell R, et al. Lancet Oncol 2012; 13: 239-246.
- Gridelli C, et al. J Clinical Oncol 2012; 30: 3002-3011.
- Wu Y, et al. Lancet Oncol 2014; 15: 213-222.
- Sequist L, et al. J Clin Oncol 2013; 31: 3327-3334.
- Haratani K, Hayashi H, Tanaka T, et al. Ann Oncol 2017; 28(7): 1532-1539.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.